

НАМАЛЕНИЕ НА РИСКА ОТ РЕЦИДИВ С 39% ПРИ ПАЦИЕНТИ С МЕЛАНОМ СТАДИЙ IIB И IIC СЛЕД РЕЗЕКЦИЯ, ЧРЕЗ ПРИЛАГАНЕ НА KEYTRUDA® КАТО АДЮВАНТНО ЛЕЧЕНИЕ1
ЗНАЕТЕ ЛИ, ЧЕ ПАЦИЕНТИТЕ С МЕЛАНОМ СТАДИЙ IIB И IIC СА ВСЕ ОЩЕ В РИСК ОТ РЕЦИДИВ СЛЕД РЕЗЕКЦИЯ НА ТУМОРА?
След резекция на меланом стадий IIB и IIC, пациентите са все още в риск от рецидив,2 като половината от всички пациенти в стадий IIB и IIC рецидивират в рамките на 2 години.3
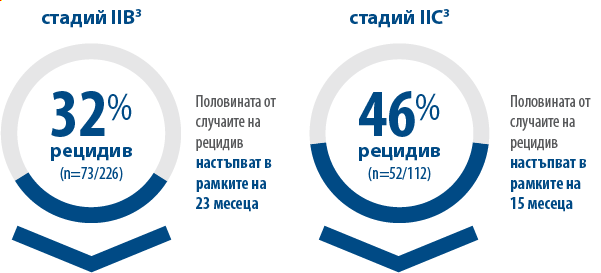
Пациентите с рецидив на заболяването са в риск да развият далечни метастази като първи рецидив.3
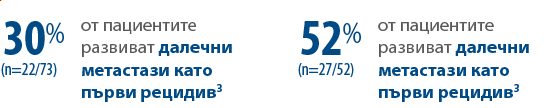
Адювантното лечение с KEYTRUDA може да намали риска от рецидив.4
ПОЛЗИТЕ ОТ KEYTRUDA® (PEMBROLIZUMAB) ЗА ВАС И ВАШИТЕ ПАЦИЕНТИ
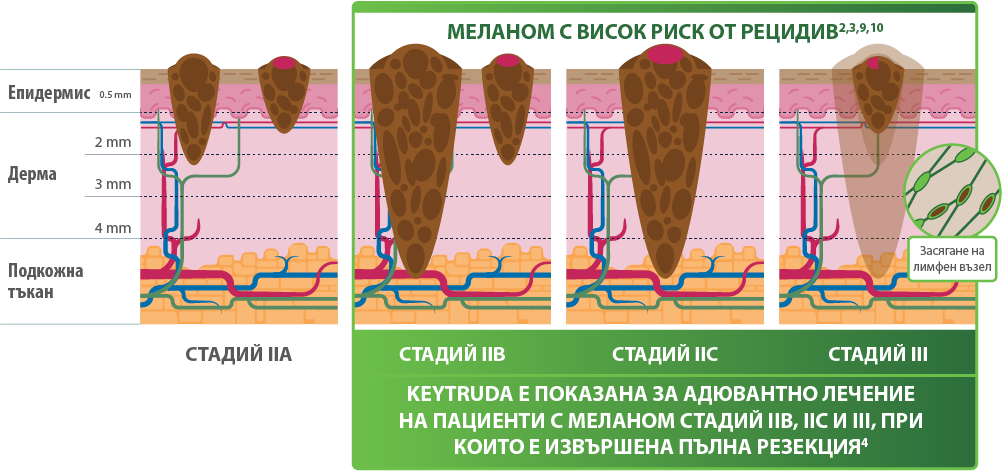
KEYTRUDA® e първият и единствен анти-PD1 инхибитор за лечение на пациeнти с високорисков меланом във всички стадии, при които е извършена пълна резекция.4–8
- Стадий IIB
- Стадий IIC
- Стадий III със засягане на лимфни възли
Сега можете да предложите на вашите пациенти адювантно лечение с KEYTRUDA® и възможност за по-продължителна преживяемост без рецидив.
ПОЛЗИТЕ ОТ KEYTRUDA ПРИ ПАЦИЕНТИ С МЕЛАНОМ СТАДИЙ IIB И IIC СЛЕД ОПЕРАЦИЯ
Доказателства от многоцентрово, рандомизирано, фаза 3 проучване KEYNOTE-7161
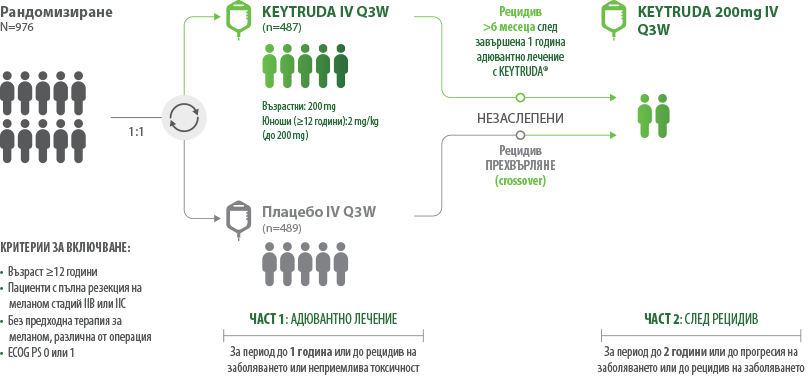


39% намаление на риска от рецидив† с KEYTRUDA®1
В цялата популация (анализ на 18-тия месец) – междинен анализ 2 (IA2)

36% намаление на риска от далечни метастази с KEYTRUDA®4
Преживяемост без далечни метастази (DMFS) – изчислени по Kaplan Meier в ITT популацията4
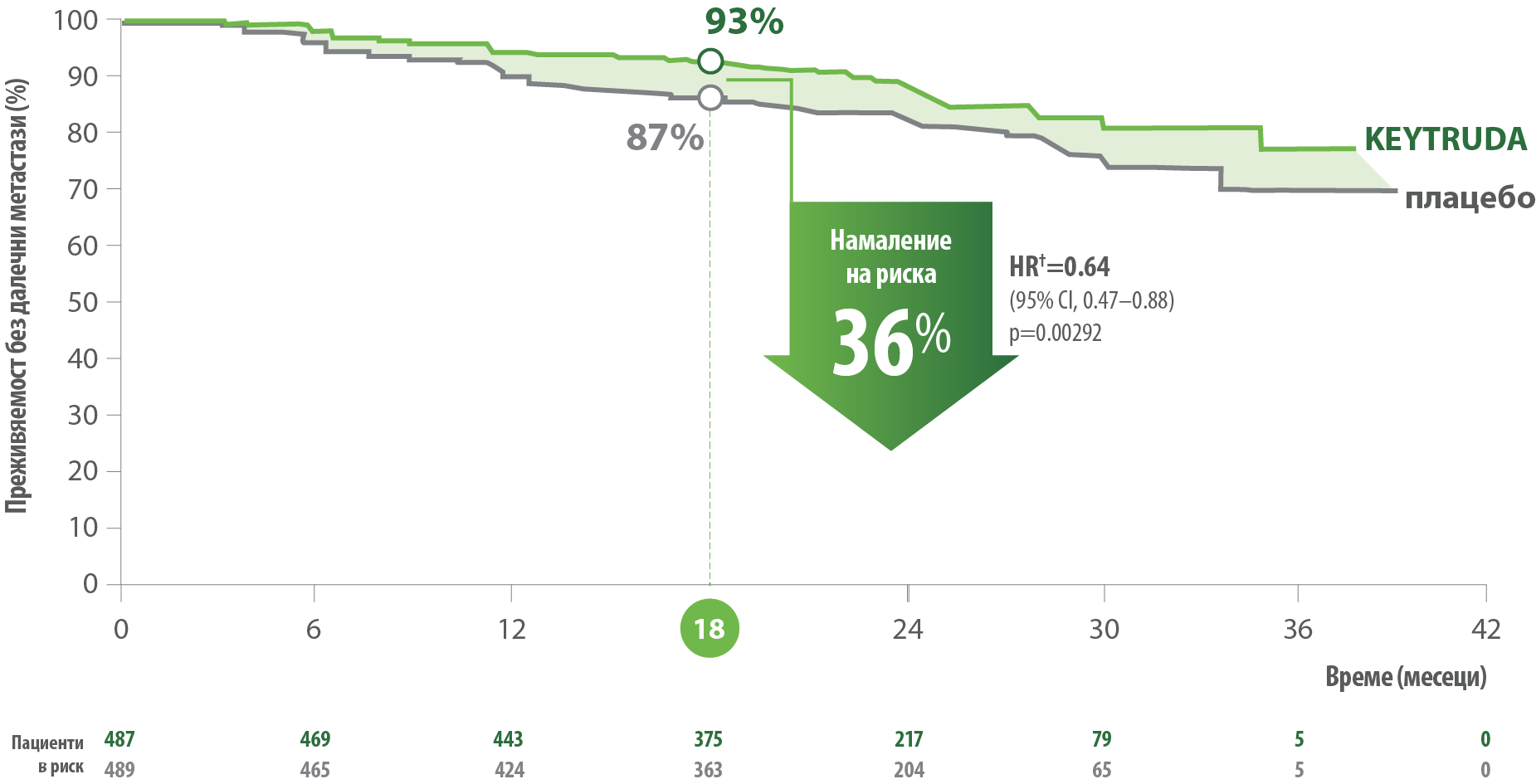
Медианата на DMFS не е достигната.4 Медиана на проследянането е 26.9 месеца (към датата 4 януари 2022).4
DMFS е дефинирана като периода от датата на рандомизиране до датата на развитие на далечни метастази. Далечни метастази са тумори, които се развиват от първичния тумор в далечни органи или далечни лимфни възли.11
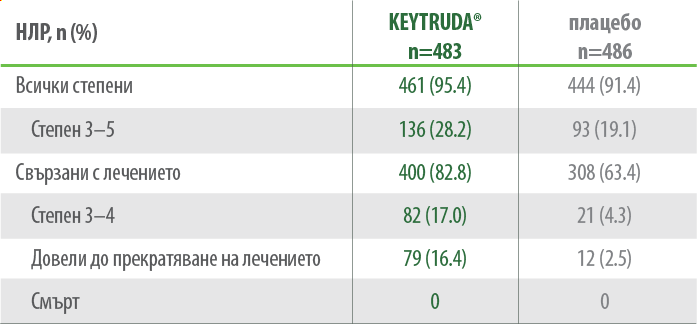
Профилът на безопасност на KEYTRUDA може да бъде контролиран и е подобен с този от предходни проучвания за меланом1
Обобщение на нежелани лекарствени реакции в KEYNOTE-716 (IA2)12
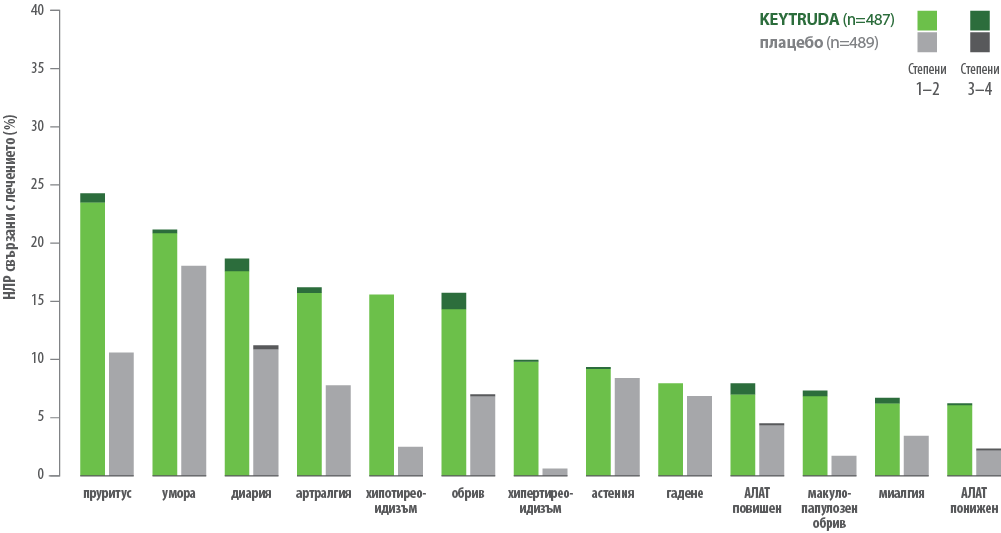
НЛР свързани с лечението с KEYTRUDA® (IA2)1
ПРЕДЛОЖЕТЕ НА ВАШИТЕ ПАЦИЕНТИ ВЪЗМОЖНОСТ ЗА НАМАЛЕНИЕ НА РИСКА ОТ РЕЦИДИВ
ПРЕМИНЕТЕ ОТ НАБЛЮДЕНИЕ НА ВАШИТЕ ПАЦИЕНТИ КЪМ ЛЕЧЕНИЕ С KEYTRUDA®!
Първото и единствено адювантно анти-PD-1
лечение след пълна резекция на високорисков меланом стадий IIB и IIC, което намалява риска от рецидив.4–8


*многоцентрово, рандомизирано, двойносляпо, плацебо-контролирано проучване при пациенти с резекция на меланом стадий IIB или IIC;
† дефинирана като периода между датата на рандомизиране и датата на първия рецидив (локален, регионален или далечни метастази) или смърт, което настъпи първо;
‡ Въз основа на стратифицирания модел на Cox за пропорционалност на риска според T стадия при меланом (T3b спрямо T4a спрямо T4b).
Съкращения:
НЛР = нежелани лекарствени реакции; АЛАТ = аланин аминотрансфераза; CI = интервал на достоверност; DMFS = преживяемост без далечни метастази; ECOG PS, Eastern Cooperative Oncology Group Performance Status; HR = коефициент на риск; IA2 = междинен анализ 2; ITT = предвидена за лечение; IV = интравенозно;; PD-1 = анти-програмирана клетъчна смърт-1; Q3W = на всеки 3 седмици.
Източник:
- Luke JJ, et al. Pembrolizumab versus placebo as adjuvant therapy in completely resected stage IIB or IIC melanoma (KEYNOTE-716): a randomised, double-blind, phase 3 trial. Lancet 2022;399(10336):1718–1729.
- Yushak M, et al. Approaches to High-Risk Resected Stage II and III Melanoma. Am Soc Clin Oncol Educ Book 2019;39:e201-e211.
- Lee AY, et al. Patterns and timing of initial relapse in pathologic stage II melanoma patients. Ann Surg Oncol 2017;24(4):939–946. doi:10.1245/ s10434-016-5642-0.
- KEYTRUDA – Кратка характеристика на продукта.
- Opdivo – Кратка характеристика на продукта.
- Yervoy – Кратка характеристика на продукта.
- Tafinlar – Кратка характеристика на продукта.
- Mekinist – Кратка характеристика на продукта.
- Gershenwald JE, et al. Melanoma of the skin. In: AJCC Cancer Staging Manual. 8th ed. American Joint Committee on Cancer; 2017:563-588.
- Mohr P, et al. Adjuvant therapy versus watch-and-wait post surgery for stage III melanoma: a multicountry retrospective chart review. MMelanoma Manag 2019:MMT33.
- Long GV, et al. Distant metastasis-free survival with pembrolizumab versus placebo as adjuvant therapy in stage IIB or IIC melanoma: the phase 3 KEYNOTE-716 study. Presented at: American Society of Clinical Oncology (ASCO) 2022 Annual Meeting; June 3–7, 2022; Chicago, IL, and online.
- Luke JJ, et al. Pembrolizumab versus placebo after complete resection of high-risk stage II melanoma: updated results from KEYNOTE-716. Oral presentation at: 18th International Congress of the Society for Melanoma Research; October 28–31, 2021.
BG-KEY-01040 EXP 05/2025
Keytruda. Съкратена информация за предписване
Повече информация може да намерите в Кратката характеристика на продукта. Електронен адрес: https://spconline.msd-info.net
За допълнителна информация или за да съобщите за нежелана лекарствена реакция използвайте: dpoc.bulgaria@merck.com
Име на лекарствения продукт: Keytruda (pembrolizumab)
Качествен и количествен състав: Всеки ml концентрат съдържа 25 mg pembrolizumab.
Терапевтични показания: Като монотерапия за лечение на възрастни и юноши на 12 години и по-големи пациенти с: авансирал меланом (неоперабилен или метастатичен), адювантно лечение на меланом стадий IIB, IIC или III; като монотерапия или в комбинация за лечение на възрастни пациенти с: метастатичен или локално авансирал недребноклетъчен карцином на белия дроб (NSCLC), метастатичен (не)сквамозен NSCLC, рецидивиращ или рефрактерен класически Ходжкинов лимфом при възрастни и педиатрични пациенти на възраст 3 години и по-големи, локално авансирал или метастатичен уротелен карцином, рецидивиращ или метастатичен сквамозноклетъчен карцином на главата и шията, авансирал бъбречноклетъчен карцином (RCC), адювантно лечение на бъбречноклетъчен карцином, неоперабилен или метастатичен колоректален карцином (CRC) с висока микросателитна нестабилност (MSI-H) или дефицит в механизма за възстановяване на несъответствията на ДНК (dMMR) при възрастни, локално авансирал неоперабилен или метастатичен карцином на хранопровода или HER-2 негативен аденокарцином на гастроезофагеалната връзка при възрастни, локално авансирал или ранен стадий на тройнонегативен карцином на гърдата (TNBC) с висок риск от рецидив, локално рецидивиращ неоперабилен или метастатичен TNBC, персистиращ, рецидивиращ или метастатичен цервикален карцином, авансирал или рецидивиращ ендометриален карцином при възрастни, MSI-H или dMMR тумори при възрастни с: авансирал или рецидивиращ ендометриален карцином (прогресирал по време или след предходно лечение с платина-базирана терапия при всякакви условия) и неоперабилен или метастатичен карцином на стомаха, тънките черва или жлъчката (прогресирали по време или след поне една предходна терапия).
Дозировка и начин на приложение: Препоръчителната доза Keytruda при възрастни е 200 mg на всеки 3 седмици, или 400 mg на всеки 6 седмици, приложена като интравенозна инфузия в продължение на 30 минути. Препоръчителната доза KEYTRUDA като монотерапия при педиатрични пациенти на възраст 3 години и по-големи с cHL или пациенти на възраст 12 години и по-големи с меланом е 2 mg/kg телесно тегло (до максимум 200 mg) на всеки 3 седмици, приложена като интравенозна инфузия в продължение на 30 минути. За употреба в комбинация, вижте Кратката характеристика на продукта (КХП) на съпътстващите терапии
Противопоказания: Свръхчувствителност към активното вещество или към някое от помощните вещества.
Специални предупреждения и предпазни мерки при употреба: Оценка на PD-L1 статуса според добре валидирана и надеждна методология. Ако е посочено в показанието, подборът на пациенти за лечение с KEYTRUDA въз основа на MSI-H/dMMR туморен статус трябва да се потвърди чрез валидиран тест. При съмнение за имуносвързани нежелани реакции трябва да се осигури подходяща оценка, за да се потвърди етиологията или за да се изключат други причини. Приложението на пембролизумаб трябва окончателно да се преустанови при всяка повторно възникнала имуносвързана нежелана реакция от степен 3 и при всяка имуносвързана нежелана реакция от степен 4, свързана с токсичност, с изключение на ендокринопатии, които се контролират със заместващи хормони (вж. точки 4.2 и 4.8 на КХП).
Нежелани лекарствени реакции: Зависят от това дали се провежда моно- или комбинирано лечение. С най-голяма честота са описани: имуносвързани нежелани реакции, които отшумяват след въвеждане на подходящо лечение или при прекратяване на приложението; анемия, неутропения, тромбоцитопения, лимфопения, хипотиреоидизъм, хипертиреоидизъм, сърдечнa аритмия (включително предсърдно мъждене), миокардит, хипертония, намален апетит, главоболие, дисгеузия, безсъние, диспнея, кашлица, пневмония, пневмонит, диария, хепатит, коремна болка, гадене, повръщане, запек, обрив, дерматит, алопеция, пруритус, мускулно-скелетна болка, артралгия, миозит, болка в крайниците, умора, астения, оток, пирексия, инфекция на пикочните пътища, хипокалиемия, хипонатриемия, повишена аланин аминотрансфераза, повишена аспартат аминотрансфераза, повишен креатинин в кръвта, повишена липаза.
Взаимодействие с други лекарствени продукти и други форми на взаимодействие: Не се очакват метаболитни взаимодействия от типа „лекарство-лекарство“. Употребата на системни кортикостероиди или имуносупресори трябва да се избягва преди началото на приложение на пембролизумаб.
Фертилитет, бременност и кърмене: Жените с детероден потенциал трябва да използват ефективна контрацепция по време на лечение и поне 4 месеца след последната доза пембролизумаб. Пембролизумаб не трябва да се използва по време на бременност, освен ако клиничното състояние на жената налага лечение с пембролизумаб. При кърмене рискът за новородените/кърмачетата не може да бъде изключен и трябва се вземе предвид ползата от кърменето за детето и ползата от терапията с пембролизумаб за жената. Липсват клинични данни относно възможните ефекти на пембролизумаб върху фертилитета.
Притежател на разрешението за употреба: Merck Sharp & Dohme B.V.Waarderweg 39 2031 BN Haarlem, Нидерландия
Начин на предписване: Терапията трябва да се започне и наблюдава от лекари, специализирани в лечението на ракови заболявания и в съответствие с официалните препоръки.